イオン結合の学習が終わってその後は共有結合。そしてその応用編として配位結合と錯イオン。順調に進んではいますが、それがなかなか実験もできず「講義」になりそうないやな予感。そこで活躍してくれるのが分子模型キット。一昨年度個人的に購入してあったもの。
まずはアンモニアをつくります。その時の窒素モデルには、価標を刺す穴が3個のものと4個のものがあって、気がつく生徒は気がつきます。どっち使うんですかぁ?という感じ。でも、電子式を書いたら三個でOKということがわかるのです。
ここで共有結合から配位結合に入っていきます。水素が電子を放出して水素イオンに変化して、さっきのアンモニアにあった不対電子を共有させてもらう。配位結合です。あーだからさっきの4個穴がいるのかぁとなって納得。ここには電子が出てこないけど、この水素が電子を放出してるのね・・・でも見方によってはどれが配位結合かわからないから、結局共有結合と区別がつかないのかよぉ、アンモニウムイオンと納得してくれます。



そしてそこに登場するのが金属の銅。アンモニア分子(NH₃)が、銅イオン(Cu²⁺)に自分の電子対を貸して結合する。
そんな「貸してつながる」優しい関係が錯イオンの本質なんだと伝えました。
ただし、テトラアンミン銅 (II) イオン、[Cu(NH₃)₄]²⁺という記号や名称で「うわ、絶対に理系やめる」という声が聞こえては来ましたが、「冷静に考えたら、1年前には水酸化物イオンとかでも、え?ムズとかいってたのに、凄くないか?」というと「確かに」となっていたので、頑張って欲しいなぁ。
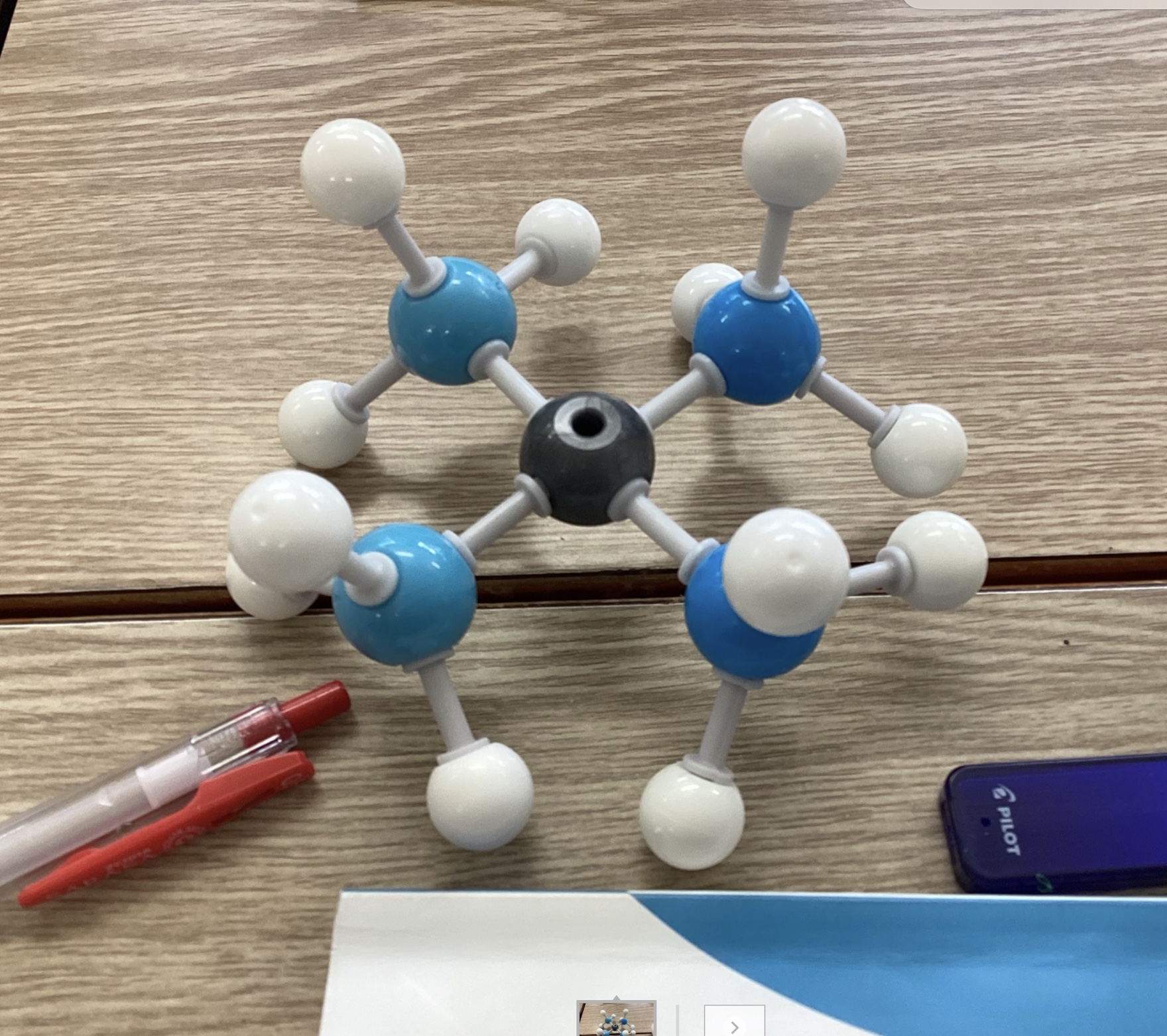
中心に銀色の球(銅イオン)を置き・・・これが銀色なのは残念・・・周囲に4つのアンモニア分子をくっつける。数の関係でこの錯イオンはクラスで2個のみ。や、でも冷静に考えると、分子模型はグループに一つとかあった方が良いのではないだろうか?いいからイラスト見て暗記しておけよっていうのは全然正義が通らない気がするんですよねぇ。
その証拠に、分子模型を見ると、「これ今日借りてっても良いですか?」という声が出てきます。そして次の日こんな感じなんです。
これ、形を維持して持ってくるだけで凄いなぁと思います。

現在、8班分しかアンモニウムイオンなどを作成する4穴の窒素がありません。教室は9班編制。買うしか無いか・・・仕方ないかな。でもまあ、これに私財を投じるのはもういい加減辞めないとというのが正直な感情ではあるんですよねぇ。
自然科学ランキング




