化学分野では、原子量や分子量・式量、アボガドロ定数などのところに入っています。
原子量がなぜ小数になるのか、イメージするための実習を行いました。
サンプルは計算問題などでもよく出題されている「塩素」です。
塩素には原子量が35の35Clが天然比で75.77%、37の原子量が24.23%存在しています。今回はそれぞれをオレンジ色のBB弾とグレーのBB弾で表現し、その存在比になるようにして混合し、クラスのグループ毎に無作為に抽出してそれぞれの数をカウントしてもらいました。

そして、オレンジ色の質量が35、グレーの質量が37だとして計算すると、塩素の質量がいくらと言えるだろうという割と単純な物です。
担当している3クラスの合計が表の通りです。まあ,天然比になるように入れてあるので当然といえば当然なのですが、きっちりと数値として表れます。
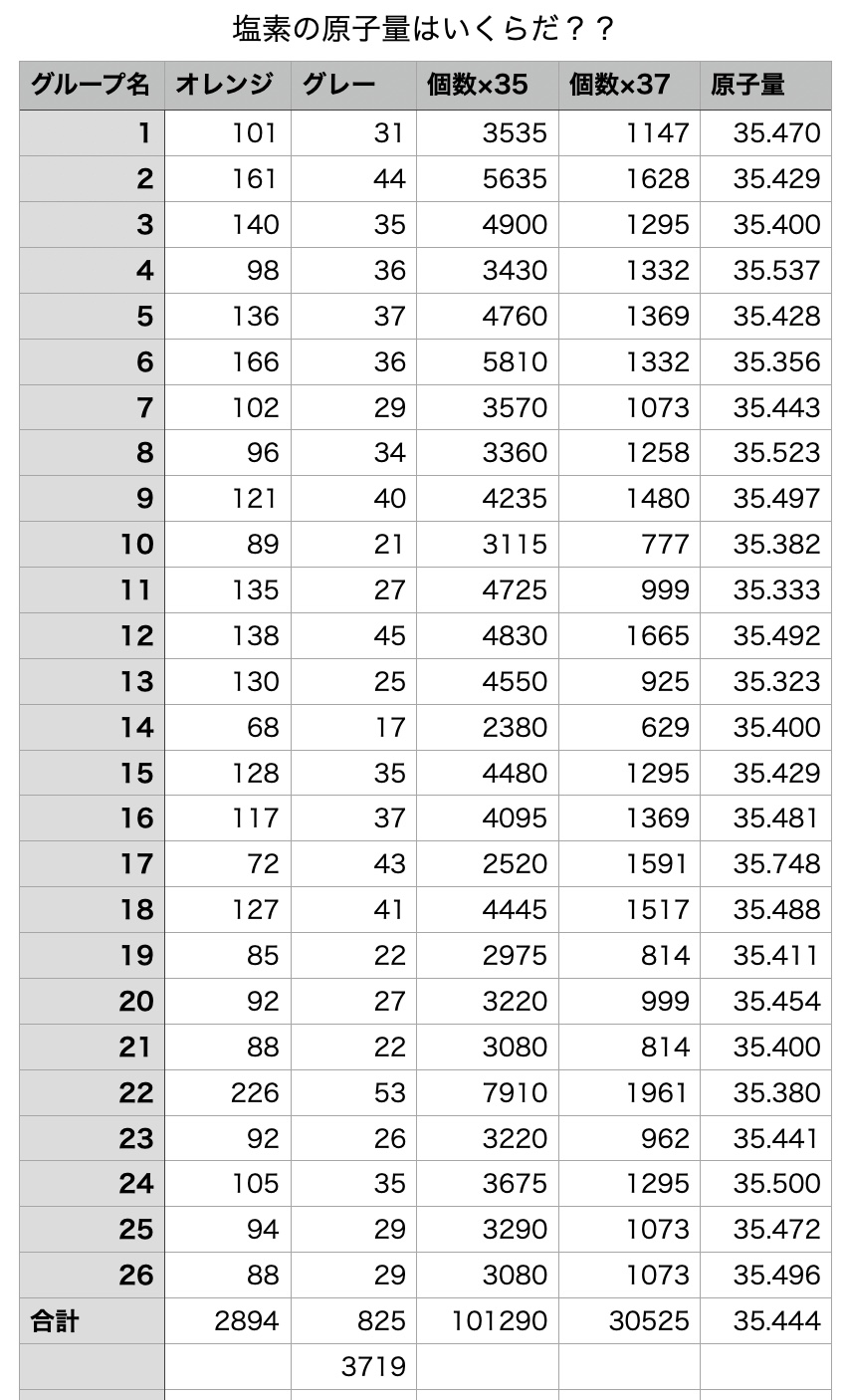
これ公式ね、計算やってみて・・・よりも少しは実感を持てるのではないかなという感じでいます。
落とさないように気をつけたり、実習後にBB弾を戻すのにどのようにこぼさない工夫をするかなんていう小さな点もグループ毎に色々違っていて面白かったです。
なんだか計算めんどくさいよなぁとなりがちなところですが、「なるほど、こういうことなのか、それで35.45なんだな」ってなったり、「じゃあ重水素ってあったけど、どうなってんだ?」という広がりが出てきたり、周期表の原子量をみて「なるほどこういうことね」とか「酸素がきっちり16.00なんだから基準でよくね?」という話にもなるわけで・・・。
こんなことやってないで「計算練習に時間くださいよ」という意見が全然出ないのが救いです。学校なんですからね、ここは。塾や予備校じゃないのです。みんながいるからできることをやらないと、少なくても自分の正義が通らないのですよ。こんな下らねえことやってないで演習問題をひたすらやらせれば良いんだってといわれたらもうそれまでということですw